Interessantissima serata con la conferenza dell’amico Mauro Giacca, ricercatore e Direttore Generali dell’ICGEB di Trieste, nonché professore di Biologia Molecolare, che condividerà a Londra le sue ricerche con la Scuola di medicina cardiovascolare del King's College.
Gambe gonfie, fiato corto, respiro che manca da sdraiati, un progressivo senso di debolezza: sono i sintomi comuni dell'insufficienza cardiaca, quando il cuore non pompa più in maniera efficace. Soffrono di questa condizione di scompenso 2-3 persone su 100 della popolazione generale, e 10-20 di quelle sopra il 70 anni: una vera e propria epidemia, visto il recente aumento dell’aspettativa di vita. Ed è un'epidemia di portata planetaria, se si considera che più di 15 milioni di nuovi casi sono diagnosticati al mondo ogni anno.
Nonostante l'impegno della comunità medica e l'enorme interesse economico (lo scompenso cardiaco assorbe da solo il 2% delle spese sanitarie dei Paesi occidentali ed è la causa del 20% dei ricoveri ospedalieri dopo i 65 anni), la situazione continua a non essere rosea. I farmaci che si usano sono datati, l'unica novità è un medicinale, chiamato Entresto, che però da solo è inefficace. Alcuni pazienti si giovano dell'impianto di pacemaker, nei casi più gravi c’è l’assistenza ventricolare meccanica (Vad), sviluppata anche questa più di 15 anni fa, delle vere e proprie pompe esterne al cuore, molto costose, impiantate per ora in pochi centri.
La prognosi della malattia, insomma, rimane piuttosto grama, con il 50% dei pazienti che muoiono entro 5 anni dalla diagnosi.
Il problema chiave dello scompenso cardiaco è la continua perdita di cellule contrattili nel corso della vita e l'incapacità del cuore di rigenerarle: quando un infarto, la pressione alta o un'infezione uccidono le cellule con cui siamo nati, queste sono rimpiazzate da tessuto fibroso, vere e proprie cicatrici.
Nuovi farmaci che stimolino la rigenerazione del cuore sono quindi necessari: farmaci biologici innovativi, che stimolino la formazione di nuovi vasi sanguigni, che proteggano il cuore da ulteriori ischemie o possano rigenerare porzioni di cuore danneggiate. Farmaci biotecnologici, basati su proteine, in particolare, sui fattori di crescita; acidi nucleici, DNA, RNA o cellule come per esempio quelle con proprietà staminale, in grado di instaurare programmi biologici che ripristinino i tessuti danneggiati.
Ci si è quindi posti la domanda se la nuova classe dei farmaci genetici, basata su segmenti di DNA o RNA, potesse essere in grado di attivare programmi biologici complicati, come appunto quelli coinvolti nella formazione dei tessuti, e da qui si è partiti. In fondo, sono i geni che durante lo sviluppo embrionale dettano le regole della formazione degli organi; logico quindi pensare di usarli anche per stimolare la riparazione nei tessuti adulti.
La possibilità dell’impiego degli acidi nucleici come veri e propri farmaci è stata resa possibile dall’enorme sviluppo della terapia genica, una rivoluzionaria modalità terapeutica concepita alla fine degli anni ‘80, inizialmente per la cura delle malattie ereditarie. Se si pensa di curare le malattie causate da un difetto genetico inserendo all’interno delle cellule una copia normale del DNA, che invece è mutato nei pazienti, come sembra ormai efficace in molte situazioni, perché non sfruttare le stesse tecnologie per iniettare anche altri tipi di acidi nucleici (in particolare RNA con funzione regolatoria) nel caso specifico in grado di rimettere in moto la replicazione dei cardiomiociti anche nel cuore adulto?
La possibilità di indurre la rigenerazione del cuore stimolando la capacità delle cellule cardiache già differenziate a riprendere la proliferazione è basata su due considerazioni:
- Durante lo sviluppo embrionale e poi fino alla nascita, il cuore è un organo che assolve alla sua funzione di pompa e allo stesso tempo contiene più del 35% dei cardiomiociti in fase di attiva replicazione. Questa proliferazione si interrompe alla nascita, per motivi quasi del tutto ignoti, e la successiva crescita del cuore avviene tramite l’ingrandimento del citoplasma delle cellule esistenti. Inoltre, nelle specie in cui la rigenerazione cardiaca avviene anche nell’adulto il processo non è sostenuto dalle staminali, ma dalla proliferazione di cardiomiociti adulti.
-Il modesto ricambio di cardiomiociti, che si verifica normalmente in un cuore durante la vita adulta, non è alimentato dalle staminali, ma dai cardiomiociti adulti che possono proliferare, anche se in maniera insufficiente a riparare un infarto. Quando si pensa alle potenzialità rigenerative delle cellule staminali, dovremmo però anche domandarci di quanto possa essere accessibile una medicina basata sul loro uso, specialmente quando il problema è rappresentato dalle malattie cardiovascolari, che colpiscono 1/3 dell’umanità e in cui l’80% dei pazienti vive nei paesi meno avanzati. Sviluppare una procedura che preveda il recupero di staminali dal cuore, la loro espansione in laboratori avanzati e certificati e la loro reintroduzione mediante sofisticate procedure non sembra sostenibile in termini di accessibilità e costi.
Da qualche anno sappiamo che il DNA, oltre a contenere i geni che codificano per circa 20.000 proteine diverse, include anche geni che producono filamenti di RNA con funzioni di regolazione. Prima nel nucleo e poi nel citoplasma, questi RNA subiscono una serie di tagli enzimatici che ne riducono le dimensioni fino a generare piccoli RNA, a doppio filamento, chiamati microRNA. Ciascun microRNA si associa quindi agli RNA messaggeri della cellula che portano una sequenza complementare e, con vari meccanismi, blocca la produzione delle proteine da questi codificate. Dato che un microRNA può avere come bersaglio centinaia o migliaia di diversi RNA messaggeri cellulari, ciascuno di questi RNA può regolare interi programmi cellulari complessi, quali l’identità funzionale di una cellula, la sua morte o sopravvivenza, il suo livello di proliferazione.
La scoperta di questo meccanismo molecolare di regolazione dei geni, chiamato “interferenza a RNA”, è valsa nel 2006 ai suoi scopritori, i ricercatori Andrew Fire e Craig Mello, il premio Nobel per la medicina o la fisiologia.
Partendo da queste considerazioni, nel laboratorio all’ICGEB, si è cercato di capire se, in una collezione di quasi 1000 microRNA umani, ce ne fossero alcuni capaci di stimolare la proliferazione dei cardiomiociti e si è scoperto che 40 microRNA possono stimolare la proliferazione dei cardiomiociti isolati dal cuore di topi e ratti neonati, anche cardiomiociti umani, ottenuti dalle cellule staminali.
L’effetto di questi microRNA è impressionante: le cellule cardiache continuano a proliferare una volta prelevate e, dopo solo qualche giorno, riempiono le piastre in cui sono coltivate. C’è un duplice interesse in questa scoperta. Da un lato è importante capire come questi microRNA funzionano, qual è il programma genico modificato con la loro somministrazione. A questo proposito, diversi di questi microRNA sono espressi ad alti livelli nella vita embrionale, quando il cuore ancora prolifera, mentre poi scompaiono subito dopo la nascita.
L’altro motivo di interesse è legato alla possibilità di sfruttare direttamente le proprietà dei microRNA per stimolare la rigenerazione del cuore dopo un infarto. A sostegno di questa possibilità, avevamo scoperto che, in maniera sorprendente, alcuni microRNA identificati rimettevano in moto la proliferazione anche dei cardiomiociti prelevati da cuori adulti.
Sintetizzando, si tratta di un nuovo meccanismo che controlla la proliferazione delle cellule del cuore.
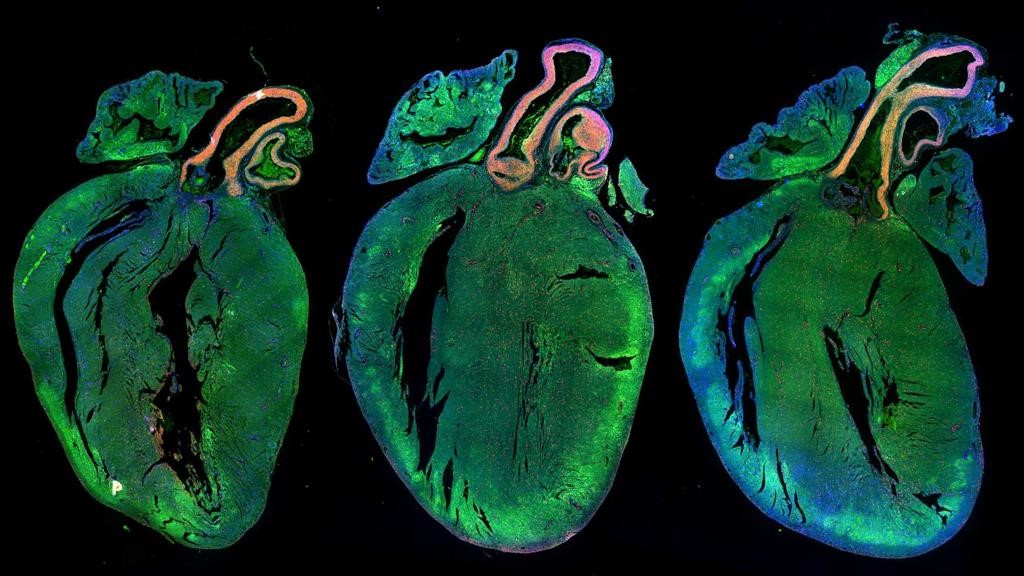
Il passaggio successivo è sicuramente più ambizioso: volevamo capire se i microRNA identificati promuovevano anche la riparazione del miocardio dopo un infarto; l’equipe dell’ICGEB ha modificato due virus per veicolare i geni che codificano per i microRNA nel cuore, in modo da consentirne una continuata produzione nel tempo e si sono iniettato i vettori in grado di veicolare due microRNA nel cuore dei topi dopo un infarto… i risultati non hanno deluso: l’infarto era ridotto di dimensione, la parete cardiaca, anziché assottigliata da una cicatrice, conteneva ancora una grande quantità di tessuto contrattile e, soprattutto, la funzione cardiaca, misurata con l’ecografia, era quasi simile a quella di un cuore normale.
Senza creare esagerate aspettative, i risultati incoraggianti conseguiti finora porteranno dei progressi nella medicina clinica, i microRNA potrebbero essere usati come farmaci genetici, in grado di rimettere in moto la proliferazione cardiaca, e quindi somministrati nelle condizioni in cui il cuore perde parte del suo tessuto contrattile, come nell’infarto e in diverse cardiomiopatie.
È ancora presto per capire se e quando i microRNA identificati potranno trasformarsi in farmaci iniettabili, c’è ancora molta strada da fare prima di arrivare alla sperimentazione clinica, ma, a differenza di qualche anno fa, oggi il traguardo della rigenerazione cardiaca sembra ragionevole da inseguire.
Un caloroso ringraziamento all’amico Mauro ha dimostrato l’apprezzamento per la brillante ricerca della sua squadra.